

上海张江转化医学研发中心
精准医学系列专辑
肿瘤外泌体研究进展及技术平台简介
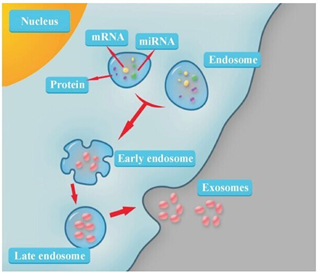
一、Exosome简介
2013年,美国、德国3位科学家凭借他们所发现的细胞囊泡运输的调节机制,荣获2013年诺贝尔生理学或医学奖。而外泌体作为细胞囊泡运输中非常重要的组成部分受到越来越多的关注,相信日后将会有更多外泌体相关机制和功能被发现、研究策略也将不断丰富与完善。
外泌体(exosome)是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的一种直径约30~120nm的膜性囊泡。最早由Johnstone等研究者在研究网织红细胞向成熟红细胞转变过程时发现[1]。又经过多年研究,科学家发现exosome的来源广泛,除了网织红细胞以外,T细胞、B细胞、血小板、树突状细胞、肥大细胞等血细胞及上皮细胞、肿瘤细胞等其他非血源性细胞都会分泌exosome,被分泌出的exosome会进入各种体液如羊水,腹水,鼻灌洗液,唾液,血清,血浆,乳汁,尿液,脑脊髓液等中,通过循环系统到达其他细胞与组织,产生远程调控作用[2]。
(一)Exosome的形成
与细胞代谢过程中产生的其他膜性小囊泡不同,exosome是经由内体途径生成(图1)。细胞内晚期内体的界膜多处凹陷,向内出芽形成管腔状囊泡,从而转变为具有动态亚细胞结构的多囊体(multi-vesicle bodys,MVBs)。当MVBs与溶酶体融合后,其内的管腔状囊泡发生降解;而与胞膜融合后,其内的管腔状囊泡再次凹陷以内出芽方式形成颗粒状小囊泡,并释放入细胞外环境,即exosome[3]。Exosome的生成是一个连续性的过程,某些类型的细胞如血小板经活化刺激后可增加exosome的释放,其他因素如自由基压力、UV放射、膜胆固醇含量降低及胞内钙离子水平升高等也能增加exosome的含量。经过两次内出芽,内体中各种物质被分选后载入exosome。不同细胞来源exosome表面携带有相似的保守蛋白,如CD9、CD63、CD81、Alix、Tsg101等,其内则分别含有与其来源细胞相关的特异性生物学物质。这些物质不仅能反映其来源细胞的类型(如成熟网织红细胞来源Exosome含有大量转铁蛋白受体,而淋巴细胞或树突状细胞来源exosome中则含量较少),更重要的是还与其来源细胞的生理功能或病理改变密切相关(如肿瘤细胞来源的exosome既含有肿瘤抗原又含有肿瘤特异性miRNA)。
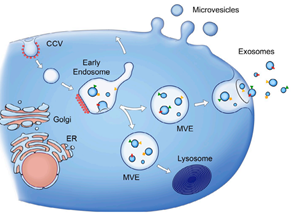
图1.Exosome的形成(Raposo et al. J Cell Biol. 2013, 200: 373-383)
(二)Exosome的组成
Exosome内含物的很大部分是蛋白质,大致可分为两类:一类是分布于exosome的表面或内腔中参与exosome结构形成的蛋白质,如肌动蛋白、微管蛋白和微丝结合蛋白等细胞骨架成分;膜转运和融合相关蛋白,如:Annexins、Alix、Flotillin、多种Rab蛋白和Tsg101等;另外一些信号分子如蛋白激酶、G-蛋白等;还有大量与exosome生成密切相关的四跨膜区蛋白质超家族成员,如CD9、CD63、CD81和CD82等。许多exosome中还存在抗原呈递分子MHC-I与Hsp70或Hsp90等分子。另一大类蛋白质则与细胞来源有关,有些exosome中甚至含有其来源细胞中的大部分蛋白质种类。例如:抗原呈递细胞来源的exosome中含有丰富的MHC-I和MHC-II、CD80和CD86;血小板来源的exosome中含有血友病因子和整合蛋白CD41a;而T淋巴细胞分泌的Exosome表面带有穿孔蛋白和颗粒酶。肿瘤细胞产生的exosome中还可以检测到过度表达的蛋白质标志物,如FasL、TRAIL和TGF-β等肿瘤抗原和免疫抑制蛋白,这使得exosome在肿瘤及相关疾病的诊断中具有重要的潜在应用价值。

图2. Exosome的组成(Zhang et al. Journal of Hematology & Oncology,2015, 8:83)
除蛋白质外,exosome中还含有大量的mRNA和miRNA。Exosome不仅保护体外RNA稳定存在,还能够作为载体将RNA转运到特定的靶细胞中,发挥重要调控作用。从人乳汁中提取的exosome中含有60余种与免疫调节相关的miRNA;胶质瘤细胞的exosome中则含有大量与细胞增殖迁移、血管形成和免疫反应相关的mRNA;肿瘤来源的exosome中miRNA的存在极为普遍并且丰度较高,在肿瘤自身的调控中发挥重要作用,已成为目前的研究热点。研究发现,RNA含量丰富的exosome,主要参与组织间遗传信息的传递过程;RNA含量低的exosome,如免疫细胞来源的exosome,主要在抗原递呈和免疫共刺激过程中发挥作用。
Exosome中的脂类分子主要是细胞质膜及其类似成分,另有一些与来源细胞相关的特殊脂类。这些脂类分子不仅参与维持exosome的形态,还可作为信号分子参与许多生物学过程,如对Notch等一些关键肿瘤生存信号通路的抑制,引起细胞凋亡,以及对前列腺素、磷酸激酶A2、C和D等一些中间信号分子的传递,参与细胞间通讯。
随着蛋白质组学研究和基因测序技术的快速发展,已经证明exosome复杂的结构,并且已经发展出一个数据库(http://microvesicles.org; http://exocarta.org)用于描述囊泡内容物的具体成分。据检测结果,细胞外囊泡可以携带92,897种蛋白质,584种脂类分子,4,934 种miRNAs及27,642种mRNAs。肿瘤患者和自身免疫性疾病患者exosome的含量比正常人要高,这表明其在各种疾病中的重要作用,然而,参与疾病进展的具体exosome内容物与具体机制仍然是一个挑战。许多数据表明在不同的理化状态下(电离辐射、发热、低pH状态、高血钙、氧化应激、缺氧),相同细胞系所分泌的囊泡的数量和内容物可以完全不同。这意味着细胞通过释放exosome进行通讯以及在不利条件情况下的调节作用。由于exosome的特殊组成,能够广泛参与到细胞通讯过程中,因此具有很好的药物释放系统开发潜力。
研究发现,抗原提呈细胞(APC)分泌的exosome可以刺激T细胞的体外增殖和诱导体内的抗肿瘤免疫反应。从肿瘤细胞中分泌出的包含肿瘤抗原的exosome则可以通过APC交叉呈递给细胞毒性T淋巴细胞(CTL),使其产生肿瘤杀伤作用。因此,exosome作为一种潜力巨大的肿瘤疫苗,得到了广泛的研究。然而,有学者发现肿瘤细胞来源的exosome对肿瘤生长具有促进作用。一项研究报道,给予预先种植卵巢癌细胞的小鼠腹腔注射从卵巢癌患者腹腔积液中分离出的exosome,可以明显促进小鼠腹腔内肿瘤的生长。从小鼠皮下肿瘤实体中分离出exosome,证实其具有促进肿瘤生长的作用。目前,已有越来越多的学者开始关注exosome在肿瘤发生和发展中的作用及其机制。
二、Exosome研究意义
Exosome在肿瘤的发病机制、诊断及治疗等领域发挥重要作用:
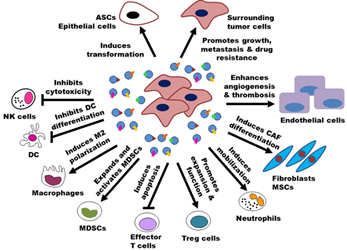
图3. Exosome在肿瘤中的作用(Zhang et al. Journal of Hematology & Oncology,2015, 8:83)
(一)Exosome参与肿瘤发生与发展
1、Exosome介导肿瘤细胞增生和干性形成
肿瘤细胞通过与自身微环境的信息交流促进肿瘤细胞的增殖和侵袭,而exosome可以充当这种信息载体。当细胞中出现基因突变时,exosome会通过膜融合把这种突变信息传递至其它正常细胞,从而导致原癌基因的激活、抗凋亡基因的表达及锚定非依赖性生长能力的增加,使肿瘤细胞获得增生的特性。肿瘤细胞来源的exosome(tumor-derived exosomes,TDEs)通过直接抑制免疫细胞,或调节相关细胞因子的表达等途径,促进肿瘤细胞的免疫逃逸,为肿瘤细胞在体内生长创造条件。Exosome从肿瘤细胞分泌后,在新的环境中通过分泌蛋白质调节肿瘤转移前的微环境,而这一微环境的改变将明显影响肿瘤细胞的干性。一系列研究表明,exosome能够反映肿瘤细胞的缺氧状态,缺氧的微环境可维持肿瘤细胞的自我更新和多向分化潜能,exosome可以通过上调Notch、Wnt等多种信号通路影响肿瘤细胞的干性。
2、Exosome介导肿瘤免疫耐受
肿瘤细胞来源的exosome(TDEs)可作为肿瘤抗原,同时也能将肿瘤抗原呈递至抗原递呈细胞,引起抗肿瘤免疫应答反应,因此,TDEs既是一种抗原呈递系统,同时也是肿瘤排斥抗原的来源。TDEs也能传递某些抑制信号,在机体免疫应答过程中起负性调节作用,诱导肿瘤细胞形成免疫耐受。免疫耐受是肿瘤细胞逃避免疫监视的主要原因,exosome介导的免疫耐受与其含有的肿瘤相关抗原和免疫抑制分子相关,这些免疫分子能够下调免疫系统的表达。有研究表明,TDEs诱导的免疫耐受与其表面FasL相关联,Fas存在于多种细胞表面,当机体受到外界刺激后,Fas含量迅速上升,并通过Fas/FasL途径诱导细胞死亡,以此来调节免疫应答以及维持免疫耐受。
3、Exosome介导肿瘤免疫逃逸
髓源性抑制细胞(Myeloid-derived suppressor cells,MDSCs)是骨髓来源的一群异质性细胞,是树突状细胞(DCs)、巨噬细胞和(或)粒细胞的前体,具有显著抑制免疫应答的能力。在荷瘤小鼠和肿瘤患者体内这类细胞增多,并促进了肿瘤的生长。来自法国国家健康与医学研究院的研究人员们从小鼠细胞系培养上清中分离出肿瘤来源的exosomes(TDEs),并发现exosome上的HSP72通过激活STAT3抑制了MDSCs的免疫抑制作用。另外,肿瘤来源的可溶性分子通过Erk激发了MDSCs的扩增。Exosome的HSP72通过TLR2/MyD88依赖的方式诱导IL-6的自分泌,从而激活STAT3。更重要的是,在3个不同的小鼠肿瘤模型中使用dimethylamilorid(二甲基阿米洛利)抑制exosome的分泌可增强化疗药物cyclophosphamide(环磷酰胺)的抗肿瘤效果。人肿瘤细胞系来源的exosome可激活MDSCs,从而激发其Hsp72/TLR2依赖的免疫抑制作用。用amiloride(阿米洛利,一种高血压治疗药物,也可抑制Exosome的形成)处理肿瘤病人来源的MDSCs可降低其免疫抑制作用。该工作发现TDEs含有膜蛋白HSP72,促进MDSCs的免疫抑制功能,抑制了肿瘤的免疫监督,从而介导了肿瘤的免疫逃逸[4]。
4、Exosome介导肿瘤耐药
多药耐药是指肿瘤细胞通过各种机制进行抵抗细胞抑制药物和细胞毒性药物的作用。主要由细胞膜蛋白ATP-binding cassettes(ABCs)将毒性物质排出胞外。另一个机制是细胞色素P450的变异活性(由CYP基因家族的遗传性变异造成的),这使得细胞能够更快地代谢药物。此外,肿瘤已经发展出各种有效的系统用于DNA损伤修复。研究表明exosome对肿瘤细胞对细胞抑制药物的无反应性起到至关重要的作用,这一假说是在顺铂与耐药性卵巢瘤中得到证实的,实验中用药越多,exosome释放量越大,并且,exosome是药物流出胞内的一种途径。顺铂治疗后各种转运蛋白表达量也显著增多。此外在乳腺癌细胞、肺癌细胞等的实验中也表明这一现象。肿瘤内部存在异质性群体细胞,有些对药物敏感,有些则耐药,有实验表明不同亚群细胞之间通过exosome(可能的miRNA: miR-100, miR-222,miR-30a, miR-17)传递而获得耐药性[5,6]。
(二)Exosome与肿瘤的早期诊断
肿瘤在生长过程中会不断地将exosome释放到周围环境中去,同时,exosome能在4℃保存96h,或是在-70℃下保存更长时间[7],exosome几乎在所有类型的体液中均可有效检测,且肿瘤exosome的分子特征部分反映其来源肿瘤的表型;所携带的肿瘤特异性抗原和miRNA可以作为肿瘤诊断标志物。在包括膀胱癌、脑瘤、结直肠癌和黑色素瘤在内的多种肿瘤临床病例中,均能从患者血清或尿液等体液中分离exosome用于早期临床诊断。肿瘤exosome也可用于肿瘤的临床风险或疗效评估,以及预后判断。

1、可作为胰腺癌诊断的生物标志物
2015年,美国德克萨斯大学研究者Sonia A. Melo等人在Nature发布了一篇论文,报道了他们基于exosome标志物所建立的一套非侵入性的胰腺癌诊断方法,这种方法可以非常精确地从良性胰腺疾病中诊断出早期癌变。虽然这项研究还需要在更大群体范围内验证,但这种新的诊断方法已经展示出非常大的应用潜力,它可以帮助医生更准确地判断是否需要为病人进行手术。这套诊断方法主要依靠检测一种锚定在血液中exosome质膜上的磷脂酰肌醇聚糖-1(glypican-1,GPC1)来实现诊断效果[8]。
研究者从胰腺癌病人血清中分离得到的exosome中发现了这种糖蛋白,但是在其他良性胰腺疾病及正常人的血液中分离的exosome中,GPC1的含量非常低。数据表明,这项检测比传统的ELISA检测糖抗原 19-9(CA19-9)更为可靠。实验中,约有一半的非癌症病人体内CA19-9水平也很高,但是没有任何一个病人体内出现GPC1+ exosome,而且还有很多癌症病人的CA19-9水平没有超过对照水平。之前已有研究发现胰腺癌细胞中GPC1会出现过表达,且过表达的GPC1会促进肿瘤增殖和迁移。这项研究首次证明,在血清中的循环exosome可以作为一种特殊标志物用于诊断癌症。不过需要注意的是,如果不对exosome进行富集,直接检测血清中GPC1的效果并不比检测CA19-9更有效,GPC1的诊断效果需要非常好的exosome富集手段作为支持。Melo和他的同事们则首先用少量血清进行超速离心,再用携带有GPC1抗体的磁珠进行进一步富集,最后用流式细胞仪进行分析。这种方法更适合在临床实验室中作为常规检测流程进行推广。
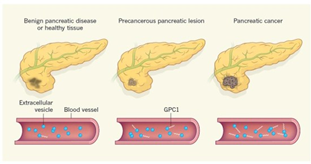
图4. 利用外泌体GPC1对胰腺癌进行诊断示意图
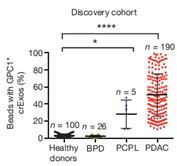
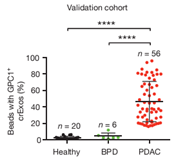
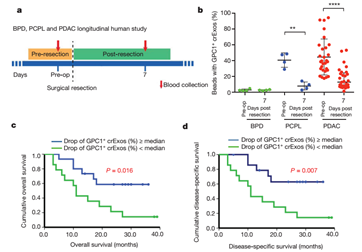
图5. 利用外泌体GPC1对胰腺癌进行诊断的结果
2、可作为黑色素瘤诊断和预后的生物标志物
恶性黑色素瘤是一种侵略性肿瘤,其发病率越来越高。近日发表在《临床化学学报》(Clinica ChimicaActa)的研究,西班牙科学家确定并评估了exosome中黑色素瘤标志物的存在,包括MIA、S100B和酪氨酸酶相关蛋白2(Tyrp2)等,及胞外体中的这些标记物的潜在临床应用价值[9]。实验收集了黑色素瘤IV期患者、非黑色素瘤患者和健康对照人群的血清样品。沉淀获得exosome;对血清、胞外体和无胞外体血清中的TYRP2、MIA和S100B的浓度进行定量。结果显示,在胞外体中检测到了MIA和S100B,并与血清浓度呈显著相关(S100B: r = 0.968;MIA: r = 0.799; p < 0.001)。黑色素瘤患者胞外体中MIA和S100B浓度显著高于健康对照人群和非黑色素瘤患者。然而,三组人群血清胞外体中TYRP2的浓度没有差异。MIA的ROC曲线分析所得峰下面积(AUC)为0.833(p < 0.01),S100B为0.840(p < 0.01)。胞外体中MIA浓度高于2.5μg/L的患者的平均生存期比胞外体中MIA水平低的患者短(前者为4个月,后者为11个月,p < 0.05)。该研究证实,在MIA和S100B黑色素瘤患者胞外体中检测到了MIA和S100B,对它们的量化具有诊断和预后的作用。
(三)Exosome与肿瘤转移
1、百年假说终获印证,exosome连接“种子”和“土壤”
一百多年前,Stephen Paget经过多年的解剖学研究发现,特定的肿瘤细胞总是倾向于转移到特定的组织器官,并于1889年提出了著名的“种子与土壤”转移假说,认为肿瘤细胞只能在适宜的组织器官环境中才能形成转移灶。由于技术限制,该假说并没有得以证明。
来自美国M.D.Anderson Cancer Center的Dihua Yu等发现正常表达PTEN的肿瘤细胞在脑部定植时,其PTEN的表达会降低,当从脑部重新分离出来后,其PTEN表达水平会恢复到之前水平。进一步研究发现肿瘤细胞转移到脑部后可以被神经胶质细胞分泌的exosome所改造,其exosome内部携带大量的miRNA-19a可以靶向肿瘤细胞内的PTEN mRNA从而影响肿瘤细胞内PTEN的蛋白水平,进而影响CCL2和NF-kB等通路促进肿瘤细胞的增殖,提升肿瘤细胞的抗凋亡能力[10]。这一发现,印证了百年前Paget的假说,脑部特定的微环境正是适宜肿瘤“种子”生长的“土壤”。
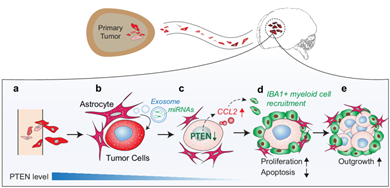
图6. Exosome参与构成适合肿瘤“种子”生长的组织“土壤”微环境
2、决定肿瘤转移的器官特异性
2015年《自然》(Nature)杂志上的一篇论文证实,肿瘤释放了数百万携带着它们的蛋白质和遗传物质的囊泡exosome,它们确保了受纳器官做好接待肿瘤细胞的准备。Exosome触发了受纳器官中必要的分子反应—炎症、血管形成等来迎接肿瘤细胞,使得肿瘤细胞到达后得以增殖。这是第一项关于肿瘤分泌的exosome在器官特异性转移中所起作用的研究。在数百万源自肿瘤的exosome中,为什么只有少数将会优先选择一些器官筑巢?是否因为肿瘤分泌的exosome具有一些特殊的分子标记,以某种方式引导至特定的器官?为了验证这一假说,研究选择了来自大约十种不同肿瘤的20个肿瘤细胞系,已知其中的一些肿瘤转移至特定靶器官:肺脏、肝脏、大脑或骨骼。蛋白质组学研究分析了肿瘤exosome中的近1000种蛋白,发现exosome中整合素(integrin)α6β4和α6β1在肺转移中起关键作用;而exosome中integrin αvβ5 在肝转移中起关键作用。如果下调integrinsα6β4和αvβ5,能分别阻止肺和肝转移[11]。这些蛋白存在于exosome膜上。
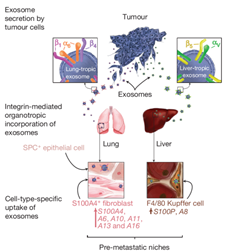
图7. Exosome决定肿瘤转移的器官特异性
3、作为转移瘤掠夺能量的利器
来自City of Hope Beckman Research Institute的研究者们发现,癌细胞通过携带高水平miR-122的囊泡在转移前微环境中抑制非肿瘤细胞的葡萄糖摄取,为即将转移过去的肿瘤细胞提供一个高葡萄糖环境,来维持肿瘤细胞高水平的糖摄取。在体内,抑制miR-122可恢复远端器官包括脑和肺的葡萄糖摄取,并降低肿瘤转移的发生率。这暗示着肿瘤exosome中miR-122可能是一个潜在的药物靶点[12]。
4、促进肿瘤侵袭和扩散
Exosome促进肿瘤侵袭和扩散主要是通过EMT--上皮间质化。细胞通过EMT改变分子表型,改变形状(细胞变为狭长导致细胞缝隙链接强度下降以及移动能力增强)。EMT主要通过各种信号通路如TGF-β1, Wntproteins, EGF, HGF和MMPs等之间的相互作用而产生。Exosome在肿瘤的快速转移也表现于其参与血管的形成。这种机制与缺氧区域高度相关。Exosome蛋白质分析可以发现IL-8和VEGF(可参与新血管形成)表达量增多[13]。
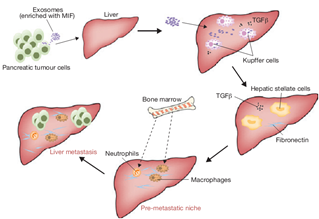
图8. 外泌体与肿瘤转移(Zhang Y et al. Nat Cell Biol.2015;17:709-711.)
2014年,宾夕法尼亚大学的研究人员在Cell上发表了关于exosome从基质细胞转移到乳腺癌细胞,从而调节其治疗耐受性通路的研究成果[14]。基质细胞和乳腺癌细胞利用旁分泌(paracrine)和近分泌(juxtacrine)信号来启动化疗和放疗的耐受性。Exosome中的RNA成分,大部分是非编码转录本和可转移元件,促进RIG-I受体的识别,从而激活STAT1依赖的抗病毒信号通路。同时,基质细胞也能激活乳腺癌细胞的NOTCH3。这种旁分泌的抗病毒作用和近分泌NOTCH3信号通路在STAT1汇合从而促进NOTCH3的转录和治疗耐受的肿瘤起始细胞的繁殖。抗病毒/NOTCH3信号在NOTCH信号通路和基质介导的耐受中的作用,能被γ分泌酶抑制剂废除。因此,基质细胞利用exosome来介导抗病毒信号参与了与乳腺癌细胞的相互作用,能够使乳腺癌耐受治疗并重新起始肿瘤的生长。
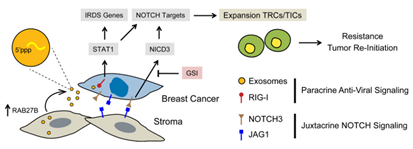
图9. Exosome促进肿瘤耐受治疗并重新起始肿瘤的生长
三、肿瘤液态活检的最新技术---Exosome检测平台
Exosome分析用于临床诊断和治疗监控显然是一个重要领域。特定的跨膜蛋白信号可以识别肿瘤特异性的exosome,而exosome内蛋白的改变可以用于推断肿瘤对治疗措施的反应。虽然exosome有如此巨大的临床价值,但是临床日常exosome分析却十分困难,主要是因为目前缺少足够灵敏且快速的试验平台,尤其是进行exosome蛋白质分析。传统流式细胞仪无法测量不到300nm的exosome;基于微粒追踪原理或动态光散射的新型计数方法仅能提供有限的分子信息;而传统的分子试验(如WB、ELISA)需要样本量大,无法适应临床上的持续分析、病人数量庞大以及有限的生物储备量等苛刻要求。
(一)目前临床检测exosome方法:
1、超速离心法
是最常用的exosome纯化手段,采用低速离心、高速离心交替进行(如图所示exosome分离提取鉴定最原始最权威的文献[15]),可分离到大小相近的囊泡颗粒。超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量[16]。
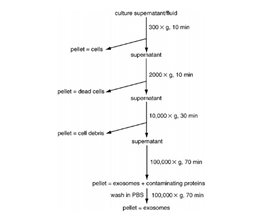
图10. 超速离心法分离exosome
2、密度梯度离心
在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。通过密度梯度离心,样品中的exosome将在1.13-1.19g/ml的密度范围富集。此法获得的exosome纯度较高,但步骤繁琐,耗时。
3、超滤离心
由于exosome是一个大小约几十纳米的囊状小体,大于一般蛋白质,利用不同截留相对分子质量(MWCO)的超滤膜对样品进行选择性分离,便可获得exosome。超滤离心法简单高效,且不影响exosome的生物活性,是提取细胞exosome的一种新方法。
4、磁珠免疫法
Exosome表面有其特异性标记物(如CD63、CD9蛋白)[17],用包被抗标记物抗体的磁珠与exosome囊泡孵育后结合,即可将exosome吸附并分离出来。磁珠法具有特异性高、操作简便、不影响exosome形态完整等优点,但是效率低,exosome生物活性易受pH和盐浓度影响,不利于下游实验,难以广泛普及。
5、PEG-base沉淀法
聚乙二醇(PEG)可与疏水性蛋白和脂质分子结合共沉淀,早先应用于从血清等样本中收集病毒,现在也被用来沉淀exosome,其原理可能与竞争性结合游离水分子有关。利用PEG沉淀exosome存在不少问题:比如纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20等化学添加物将会破坏exosome等,因此发表文章时易受质疑。
6、试剂盒提取
近几年来,市场上已出现各种商业化的exosome提取试剂盒,有的是通过特殊设计的过滤器过滤掉杂质成分,有的则采用空间排阻色谱法(SEC)进行分离纯化,也有的则利用化合物沉淀法将exosome沉淀出来。这些试剂盒不需要特殊设备,随着产品不断更新换代,提取效率和纯化效果逐渐提高,因而逐渐取代超速离心法并推广开来。
(1) Exosome Diagnostics公司推出全球首个基于exosome RNA的液体活检产品
2016年1月21日——外泌体诊断公司(Exosome Diagnostics, Inc.)宣布推出世界上第一个从血液样本分离和分析exosome RNA(exoRNA)的液态活检产品:ExoDx™ Lung(ALK)。 ExoDx Lung(ALK)已在Exosome Diagnostics公司的CLIA认证实验室得到验证,是一种基于血浆exosome的诊断产品,可灵敏、准确、实时检测非小细胞肺癌(NSCLC)患者的EML4-ALK突变。Exosome Diagnostics公司专有的exosome RNA提取平台提供了检测如EML4-ALK基因融合的方法,相比cfDNA更直接、更灵敏。通过比较病人组织ALK水平和相应的血浆样本发现该测试显示出88%的灵敏度和100%的特异性。
(2)用于exosome分析的集成磁电化学感受器[18]
IMEX将两个正交的磁性选择系统和电化学检测系统结合。使用小磁珠捕获exosome,捕获的exosome通过电化学传感器检测。IMEX的优点:①.细胞特异性的exosome可以不进行过滤和离心分离而直接从血浆中分离;②.通过磁性富集与酶联放大达到高敏感性;③.通过电流探测的机制,传感器可以迷你化再并联进行测量。
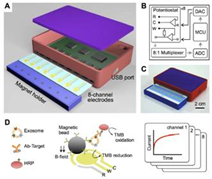
图11. 集成的磁电化学外泌体检测平台
IMEX的工作原理
第一步、用表面带有抗体小磁珠捕获exosome;
第二步、将带有HPR(氧化酶)的二抗作用于exosome;
第三步、与TMB(3,3’,5,5’-tetramethylbenzidine)混合产生电流。
使用磁珠显著简化了试验程序,捕获的exosome可通过磁力收集并提升试验的敏感度,不能被结合的过量抗体、酶可被洗去。
(3) 肿瘤exosome的新一代测序分析
MD安德森癌症中心的研究人员从三个胰胆管癌患者(两个胰腺癌、一个壶腹癌)的体液中分离出Exosome(Exosome)。使用Illumina HiSeq2500测序仪对exoDNA、exoRNA进行全基因组、外显子组和转录组测序分析[19]。在exoDNA测序数据中检测突变信号和识别潜在可行的突变,以及在exoRNA测序数据中分析表达点突变和基因融合。全外显子组测序达到95%-99%目标区域的覆盖,平均深度133-490 x。全基因组拷贝数情况,和肿瘤相关片段的高估值(56%-82%),表明exosome中含有肿瘤细胞来源的DNA片段。包括NOTCH1和BRCA2在内的多个可操作的突变在患者exoDNA样本中发现。此外,exosome的RNA测序鉴别了融合基因表达的存在,这为肿瘤新抗原的阐明提供了新的方式。Exosome的核酸成分的拷贝数概况,点突变,插入,缺失,基因融合等突变特征可作为检测各种肿瘤来源的生物标志物。基于exosome的液态活检可作为临床工具用于癌症诊断,治疗性分层,和疗效监测,不需要直接肿瘤取样,将大大造福人类健康。
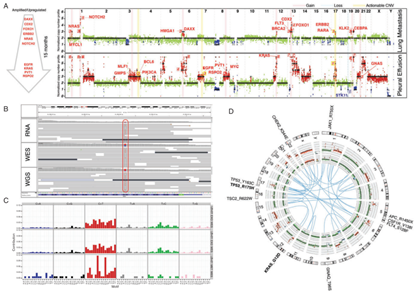
图12. 肿瘤exosome的新一代测序分析
(二)市场上的exosome分离研究方法:
分离:商品化的试剂盒如
TotalExosome Isolation Kit (from plasma) (Invitrogen™)
TotalExosome Isolation Kit (from urine) (Invitrogen™)
TotalExosome Isolation Kit (from from other body fluids) (Invitrogen™)
GS™Exosome IsolationReagent(for serum or plasma)(吉赛生物)
PureExo® ExosomeIsolation Kit (for serum or plasma)(美国101Bio)
DiagExo® Human Body FluidExosome Isolation kit(美国101Bio)
DiagExo® Urinary ExosomeIsolation Kit(美国101Bio)
研究:蛋白分离纯化后做蛋白质组分析研究,RNA分离纯化后做RNA sequence
优点:操作便捷,可标准化,分离所得exosome纯度和浓度较高。
缺点:相关产品比较多,需平行比较,择优选择(目前还没有已获得FDA/CFDA认证的试剂盒)。
(三)Exosome 分析
在下游分析方面,分离纯化出来的exosome可以做蛋白分析,也可以做RNA(microRNA和LncRNA)分析。研究人员通过Western blot或其他方法来鉴定蛋白;利用qPCR对microRNA表达谱进行分析;利用芯片进行microRNA表达谱分析;利用新一代测序(NGS)开展microRNA/mRNA研究。
1、蛋白分析
(1)SDS-PAGE:通过SDS-PAGE电泳可以分析得到的exosome中蛋白的含量及种类。
(2)Western-Blot:通过Western-Blot可以检测exosome中特定的蛋白表达情况。
(3)2-DE等蛋白组学分析:可以了解exosome中不同蛋白的表达、数量情况。
2、透射电镜
通过透射电镜可以分析exosome的大小、形态等,再结合免疫标记可以很清楚的分析特定指标在exosome表达的部位。
3、基因水平
(1)Real-Time PCR:通过PCR可以分析需要研究的指标的表达量
(2)转录组分析:通过测序或者芯片,分析exosome不同基因的转录水平
(3)miRNA :通过测序或者芯片,检测与exosome相关的miRNA的表达情况,研究特定的miRNA
(4)lncRNA分析:通过测序或者芯片,检测与exosome相关的lncRNA的表达情况,研究特定的lncRNA与exosome共同调控某种疾病的关系。
4、Exosome RNA研究策略简介
(1)差异筛选对于不同类型Exosome RNA(mRNA、lncRNA或miRNA等)的功能探索与一般的RNA分子功能研究方法并无本质区别。在进行差异筛选之前,首先要进行exosome的提取,可使