

上海张江转化医学研发中心
精准医学系列专辑
液态活检研究进展及技术平台简介
液态活检(liquid biopsy)
液态活检这一概念最早在1974年由Sorrells等提出。液态活检主要检测对象包括:循环肿瘤细胞(CTC)、循环肿瘤DNA(ctDNA)以及肿瘤外泌体(exosome)等,它们来源于肿瘤组织,存在于血液,可以提示肿瘤发展进程及抗药性等信息,指导个体化精准治疗。与现有肿瘤检测方法相比,液态活检无侵入性、可频繁多次检测及快速反应能力均体现出显著的优势,应用发展潜力巨大。从成本的角度,医疗保险有较大的动力推动液态活检的CTC与ctDNA技术对穿刺活检技术的替代。癌症液态活检也将帮助削减无效医疗开支、降低医疗成本、帮助医保控费。
美国纪念斯隆-凯特林癌症中心主任医师兼首席医疗官约瑟·巴塞戈称:“液态活检可能永久改变活检方式,包括对治疗方案的响应、抗药性的出现,将来甚至还能用于早期诊断”。2015年2月白宫官网发布的相关细节中,肿瘤治疗计划的四大举措之一就是:美国将使用“液态活检”血浆开发新方法来评估治疗反应以及抵抗可能的耐药性。
根据中国国家癌症中心发布的数据,我国5年内诊断为癌症且仍存活的病例数约为749万。液态活检临床实验的适应症广泛,如乳腺癌、结直肠癌、肺癌、胃癌、食管癌等常见肿瘤均可用液态活检技术进行诊断与监测。在我国存量肿瘤患者中,适合使用液态活检技术的肿瘤病人至少为542万人,占比达到72%。预计液态活检的目标患者人数为500万人。在同时考虑我国肿瘤发病率、液态活检适应症、未来市场渗透率、未来检测单价以及患者年平均检测次数等因素后,预测中国液态活检市场在5-10年内的市场潜力约为200亿元。
液态活检的七大应用简介:
1. 唐氏综合征:到目前为止,液态活检的主要商业应用是在怀孕期间。“无创产前检测(NIPT)”通过分析母亲血液来检测唐氏综合征。该检测通常是对DNA片段进行计数,以确定胎儿是否含有过多或过少的染色体。若要确诊唐氏综合征,仍需要进行羊膜穿刺或绒毛膜取样。
2. 罕见出生缺陷:NIPT不仅能揭示额外染色体的信息,也能让你深入了解胎儿基因组。它们能定位DNA的缺失,也就是微缺失(microdeletion),这会引起罕见疾病。斯坦福的研究人员发现,他们能对母亲血液中的胎儿完整基因组进行测序。目前,液态活检的另一个研究方向是如何发现DNA差异,以及单个碱基的突变,它们引起了单基因疾病,如囊性纤维化和地中海贫血。
3. 亲子鉴定:检测公司Natera及其合作伙伴提供一种液态活检,可确定胎儿的父亲。这项检测可在怀孕9周时进行。在此之前,对胎儿做亲子鉴定必须要等到怀孕15周。不过,检测时还需要提供所有可能父亲的血液样本。
4. 器官移植:肾脏、肝脏或心脏的移植,也可被视为基因组移植。移植之后,含有其他人DNA的细胞就出现在受体的体内。通过液态活检来追踪这些DNA,可确定器官是否被排斥。太多捐献器官的DNA可能意味着它被受体的免疫系统攻击。对于那些接受骨髓移植的患者,液态活检也被证明是有用的。
5. I型糖尿病:在I型糖尿病中,自身产生胰岛素的β细胞中胰岛素基因经历了脱甲基化改变而开启;在其他组织中,胰岛素基因被甲基化而关闭。测序仪可测定DNA链是否甲基化,能够大致追踪多少DNA是从β细胞上脱落的。
6. 癌症预测:液态活检的一大应用将是在任何症状出现之前发现癌症。研究已经表明,血液检测能在看到肿瘤之前检测到它。以便在长期吸烟者和有家族风险的人群中发现早期癌症。
7. 癌症治疗:通过血液中发现的突变DNA片段,建立癌症的遗传图谱。这种“诊断和治疗”的检测可以用来确定哪些药物适用于患者,因为癌症是由特定突变引起的,它们对某些药物有很好的响应。
另外,由于血液中肿瘤DNA的量与肿瘤的大小和阶段大致成比例,这种检测也可用来判断手术或药物治疗的效果。对于组织活检难以进行的疾病,如肺癌,液态活检特别有用(图1)。
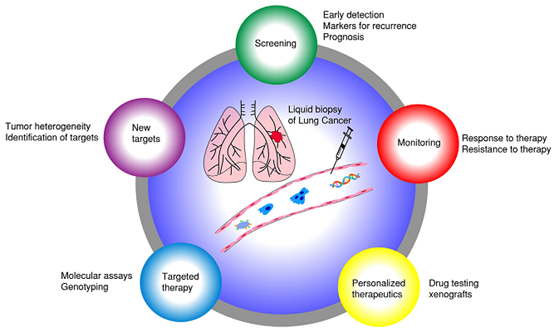
图1. 液态活检在肿瘤(肺癌)中的应用
一、液态活检之循环肿瘤DNA研究进展及技术平台简介
(一)循环肿瘤DNA (ctDNA)简介
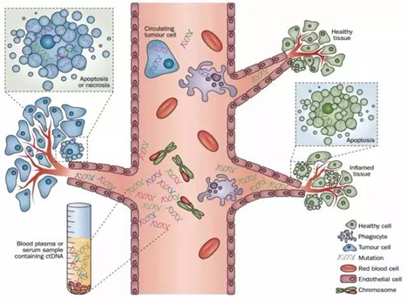
血浆游离循环肿瘤DNA (ctDNA)是由肿瘤细胞释放到血浆中的单链或者双链DNA,对ctDNA进行检测,可以对肿瘤负荷进行实时监控、药物疗效反应与预后判断等。肿瘤细胞坏死或者凋亡后,细胞中的DNA释放进入循环系统,游离地存在于血液当中(图2)。虽然这些DNA是断裂的,不完整的,但它来自于肿瘤细胞,如果肿瘤细胞携带某种基因突变,这些突变也能在ctDNA中反应出来。通过检测ctDNA的基因突变,就可以揭秘体内肿瘤组织的突变信息,从而为肿瘤的靶向治疗和药效检测提供依据。
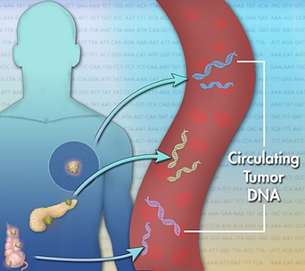
图2. 循环肿瘤DNA (ctDNA)来源
1948年,科学家第一次报告了人体血液中存在DNA循环;1977年,明确提出癌症患者血液中的DNA循环。人们又花费17年时间指出,这些DNA出现了与癌症有关的突变。血浆ctDNA直到近来才取得临床研究和应用的进展,部分原因是肿瘤DNA比胎儿DNA更难探测。它在血液中的含量非常少且极为多变。对患有晚期癌症的患者而言,肿瘤可能是血流中循环DNA的主要来源,但ctDNA仅占总数的1%,甚至少到0.01%。早期测序技术还无法探测到它1。
ctDNA可能比蛋白质生物标识表现得更好。蛋白质被用于临床疾病诊断,并对正在接受治疗的患者进行监控。例如,前列腺特异性抗原(PSA)是前列腺肿瘤的生物标识,但它却会出现假阳性结果,因为出于其他原因,这种抗原在血液中的含量也会升高。但ctDNA出现假阳性的几率更低,因为它是由具有癌细胞印记的突变和其他遗传变化定义的。尽管大多数蛋白质生物标识能在血液中存在数周,而ctDNA的半衰期不到两个小时,因此,后者呈现的是肿瘤实时的情况。剑桥团队与约翰斯·霍普金斯团队分别发现,在监测乳癌和肠癌时,与蛋白质生物标识相比,ctDNA更加敏感,并且在追踪肿瘤消失、扩散和复发时,ctDNA也更准确。另外,这两个小组还发现,ctDNA比循环肿瘤细胞更敏感。在实验中,Diaz研究小组发现,当两者都存在时,ctDNA碎片在数量上要超过循环肿瘤细胞(50:1)。在过去十年,高通量测序技术(又称为二代测序技术)迅速发展,并成功应用于遗传性疾病及肿瘤的诊断。如能将高通量测序技术运用在液态活检上,将为分子诊断开拓一个更为广阔的天地。高通量测序检测ctDNA技术只需要少量的外周血,就可以检测出肿瘤DNA中的突变。
由于ctDNA的二代测序检测准确、灵敏、无创且高通量,目前已用于靶向治疗的实时监测。英国癌症研究所Bono实验室发表在《临床癌症研究》(Clinical Cancer Research)上的文章报道了ctDNA的二代测序检测在监测靶向药物疗效中的应用。该研究来自一个针对PI3K-AKT-mTOR信号通路的靶向药物的临床实验,共39位癌症患者参与此项研究,在服药前已有不同程度的癌细胞转移迹象。首先,该研究证明外周血ctDNA中检测到的突变均在手术活检样品中出现,说明ctDNA可以反应肿瘤组织分子水平变化。
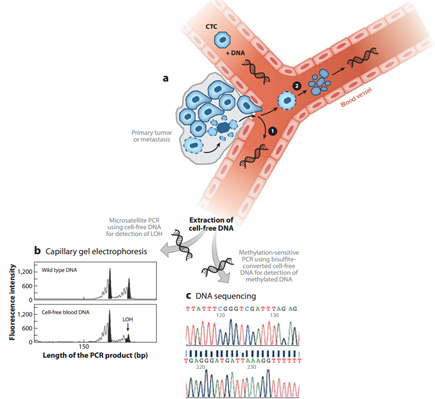
图3. 循环肿瘤DNA (ctDNA)测序
接下来,在服用靶向药物过程中,每隔一段时间收集外周血进行ctDNA测序,用以监控上述信号通路中的热点突变的变化,从而为判断药物的疗效提供依据,结果显示,ctDNA突变的变化趋势与传统CT检测到的肿瘤大小变化基本一致,实现了肿瘤分子水平监控。靶向药物针对基因突变而设计,因此ctDNA中的突变变化可以更灵敏准确地判断靶向药物的疗效。
(二)ctDNA研究进展
当前的分子诊断技术主要还是基于细针穿刺,其面临的技术局限是灵敏度问题。由于肿瘤的异质性,细针穿刺所取到的少量样本往往无法反映肿瘤突变的全貌,也可能会遗漏恶性的亚克隆。某些实体瘤如肺癌,穿刺取样存在困难和风险。所以,采用无创检测手段对血液中的ctDNA进行检测和测序,可以帮助人们通过取血得到更全面的癌症信息,告诉医生治疗是否已经起作用,肿瘤有没有演化出抗性2,3。研究发现,在前列腺癌、肺癌、乳腺癌、大肠癌、肝癌、膀胱癌、宫颈癌、胰腺癌、卵巢癌等人类恶性肿瘤中均能检测到ctDNA。目前针对ctDNA的研究主要包括以下四个方面:
1. 追踪肿瘤进化
2015年发表于《Nature Communications》杂志的一项新的研究,科学家首次发现,流进入血液中的肿瘤DNA,可用于实时跟踪肿瘤的发展以及对治疗的响应4。剑桥大学的研究人员从肿瘤已经扩散到身体其他部位的一名ER、HER-2阳性的乳腺癌患者身上,在患者治疗期间采集了8份肿瘤样本(图4-1)和9份血液样本进行外显子组和靶向扩增子测序。他们仔细研究了进入血液中的、来自死亡肿瘤细胞的小DNA片段,并将它们与在同一时间点上采集的活组织切片进行比较。
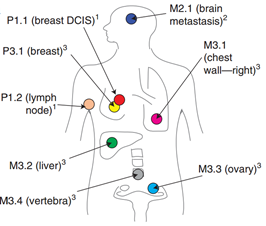
图4-1. 采集肿瘤样本(活检部位)
结果表明,血液样本中的ctDNA与活检相匹配,反映了当肿瘤发展和响应治疗时出现了相同的模式和遗传变化时机。这些结果提供了第一个原理证明,分析了血液中的ctDNA,可以准确地监测体内的癌症。使用PyClone的贝叶斯聚类分析发现8个主要的突变簇,并绘制出肿瘤进化的系统树(图4-2)。
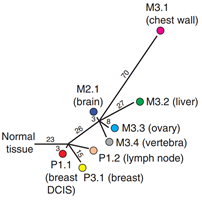
图4-2. 肿瘤进化树
本次研究的结果预示:在利用ctDNA实时监控肿瘤负荷方面,具有在血浆中丰度最高,在随访过程中不易丢失等优势的躯干突变基因(truncal mutations)将是最好的候选靶标。同时,药物治疗前血浆中的耐药相关的ctDNA突变可能为治疗方案的选择提供依据。
2. 耐药机制研究
肿瘤的靶向治疗显著提升了患者的临床治疗效果,然而不幸的是大部分患者都会产生获得性治疗抵抗。阻碍临床患者治疗的一大主要问题是对于耐药机制的理解5,6。2016年发表的两项研究显示血浆游离DNA分析能够成功检测出非小细胞肺癌和结直肠癌种EGFR靶向治疗的异质性耐药机制5。
图5. 患者血浆游离DNA采集
本研究通过对EGFR TKI AZD9291耐药的肺癌的无细胞血清DNA (cfDNA)的研究,利用高通量测序技术(next generation sequencing, NGS),发现在7个病人中有一个有EGFR C797S突变把这种突变加入肺癌细胞系中,能导致肺癌细胞对AZD9291产生耐药。随后进行了微滴式数字PCR (ddPCR),对15个经过AZD9291治疗的病人的无细胞血清DNA (cfDNA)进行了检测,发现他们在治疗之前全都有T790M突变,但是接受AZD9291治疗并耐药后,6个病人产生了EGFR C797S突变,5个病人保持了T790M突变但是没有C797S突变,4个病人失去了T790M突变,但是依然有EGFR通路的激活7。该研究表明,在治疗初期的克隆会随着时间波动,无细胞血清DNA (cfDNA)监测有助于肿瘤负荷的检测以及治疗反应的判断。
3. 预后评估
2013年发表于《新英格兰杂志》一篇研究报道:在对30名转移性乳腺癌肿瘤患者检测中,97%可成功检出ctDNA;78%可检出CA 15-3,87%可检出循环肿瘤细胞8-10。ctDNA水平显示出动态范围以及与肿瘤负荷的关联性均大于CA 15-3或循环肿瘤细胞(CTC)。ctDNA为53%的患者提供了最早的治疗反应监测指标。该研究表明,ctDNA携带肿瘤特异性变异,与现有FDA批准的生物标记物和CTC相比,能更有效监测转移性乳腺癌。
4. 药物疗效反应
2014年发表于《Sci Transl Med 》上的一篇研究报道:对转移性结直肠癌患者治疗前后血液样本中血浆游离循环肿瘤DNA分别进行全基因组、全外显子组或者目标区域高通量测序,能够发现患者体内治疗前后的不同的基因发生了一种或多种突变,这些新出现的突变可能是导致药物耐药的原因之一11。当患者样本量积累到足够大时,可以有助于鉴定肿瘤耐药或复发相关的基因或通路。
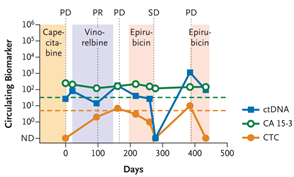
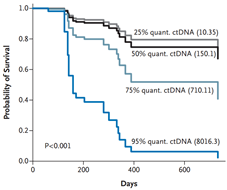
图6. ctDNA水平与疗效监控及预后评估
(三)ctDNA检测平台
过去10年间科学家发展出了更灵敏的技术,能在片刻间探测和量化DNA数量。例如,即使ctDNA与健康细胞DNA的比例为1/10000,一个名为BEAMing的技术也能将其检测出来。该技术由约翰斯·霍普金斯大学遗传肿瘤学家Bert Vogelstein和Kenneth Kinzler所开发。2007年,他们利用该技术追踪了18位接受治疗的肠癌患者。手术后,患者ctDNA水平下降了99%,但在许多病例中,该信号没有完全消失。首次术后访问发现,ctDNA的患者除一人外都出现肿瘤复发。而术后无法探测到ctDNA水平的患者没有出现复发。
如何才能够快速、准确地对ctDNA进行检测呢?对于DNA的检测,当然首推测序技术,无论是成就了人类基因组计划的双脱氧法一代测序技术,还是现在方兴未艾的二代测序技术,以及如雨后春笋般遍地开花的三代测序技术,他们的测试对象都是DNA。但考虑到ctDNA的片段长度大小一般都介于160-500bp范围内,而且含量极低,因此要采用高通量的测序技术来对如此低丰度的待测产物进行研究,也许并不一定是最佳的选择。而通过将待测样本转换成高速运动的离子,根据不同离子拥有不同的质荷比(m/z),来对待测样本进行分离和检测的质谱(Mass Spectrometry, MS)技术,则在这一领域具有广泛的优势。
1. 分离富集
ctDNA由于片段较小、含量很少.而且容易和血浆蛋白相结合,因而常规的提取效率都不高。针对血浆中ctDNA的抽提原理主要有四大类:盐析法、酚.氯仿抽提法、微柱吸附法和磁珠吸附法。目前商品化的试剂盒绝大多数都是基于以上后两种原理研发的。通过比较各类试剂盒发现,磁珠法获得的ctDNA在质量和含量上都要优于微柱吸附法,假阳性率也较低。tDNA研究的关键技术是如何从外周血中分离得到足够量的、高质量的游离DNA,相对而言该检测技术比较简单。ctDNA检测技术根据检测目的来选择相应的技术方法。其中大部分是以PCR技术为基础,如实时荧光定量PCR、甲基化特异性PCR等,也有基于微珠富集原理的方法。目前,ctDNA检测技术已经广泛地应用于肿瘤靶向治疗、诊断及预后相关标记的检测。尤其是新一代测序技术飞速发展的今天。基于ctDNA的全基因组测序、全外显子测序或全转录本深度测序方法将逐渐替代原来传统的基因突变或测序方法。
2. 检测技术
2.1数字PCR
数字PCR在如下方面优势突出:操作快速、简便(测序前无需对来源于CTC的DNA进行预扩增);无需复杂的生物信息学分析;检测灵敏度高等。在ctDNA的检测方面,NGS和ddPCR的联合使用是大势所趋。国际肺癌研究学会(IASLC)主席Tony Mok(莫树锦)会议期间提及的肺癌相关基因突变检测的方案中就体现了这一趋势。但是值得注意的是,数字PCR技术只能针对已知突变进行检测,无法像测序技术一样读出核酸序列或者检测出未知突变。
2.2高通量测序
Illumina Hiseq测序是一种基于单分子簇的边合成边测序技术,该检测平台在单次运行中实现大量基因组、外显子组的测序,让大型研究能在最少的运行中完成。测序时将基因组DNA的随机片段附着到光学透明的玻璃表面(即Flowcell),这些DNA片段经过延伸和桥式扩增后,在Flowcell上形成了数以亿计Cluster,每个Cluster是具有数千份相同模板的单分子簇。然后利用带荧光基团的四种特殊脱氧核糖核酸,通过可逆性终止的SBS(边合成边测序)技术对待测的模板DNA进行测序12。
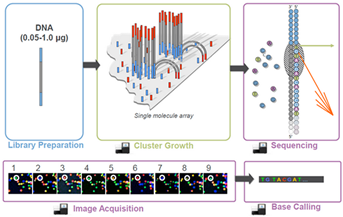
图7. Illumina Hiseq高通量测序示意图
采用芯片捕获的方法捕获基因的全外显子序列,然后进行高通量深度测序。通过测序数据分析获得基因变异数据,将所得变异信息与数据库进行对比,判断变异所属种类,出具结果报告。
2.3质谱法
质谱仪,根据其部件功能通常可分为5个部分,①进样系统,②离子源,③质量分析器,④检测器和⑤数据处理系统。对以核酸、蛋白为待测产物的质谱仪而言,其离子源一般需要采用较为温和的电离方式,比如电喷雾电离(Electrospray Ionization,ESI),基质辅助激光解吸电离(Mass-Assisted Laser Desorption/Ionization,MALDI)等类型13-15。
采用MALDI TOF质谱对ctDNA进行检测的最大优势在于准确度高、重复性好、稳定性强、检测速度快、样本处理标准化。其可用于ctDNA的基因型分析(genotyping),基因突变检测(mutation detection),DNA甲基化(DNA methylation),基因表达(gene expression),拷贝数差异(copy number variation,CNV),单倍体序列差异(haploid sequence variation,HSV)等多项检测与分析16。
所述检测已在美国麻省大学伍斯特分子诊断实验室(University of Massachusetts, Worcester Molecular Diagnostics Laboratory),梅奥医学中心(MayoClinic CLIA Lab)等世界知名科研机构与临床医院得到广泛认可与应用,并获得美国FDA批准用于临床检测。
(四)ctDNA研究策略简介
在实体瘤患者治疗前、治疗后与随访期间按照不同时间点多次采集外周血样本,分别对血浆ctDNA进行ddPCR检测或者全外显子组、目标区域高通量测序。不同时期的外周血样本基因突变类型与基因突变频率可以反映患者在治疗期间的病情进展、对药物疗效的反应以及可能的预后信息。当患者样本量积累到足够大时,可以有助于鉴定肿瘤耐药或复发相关的基因或通路。
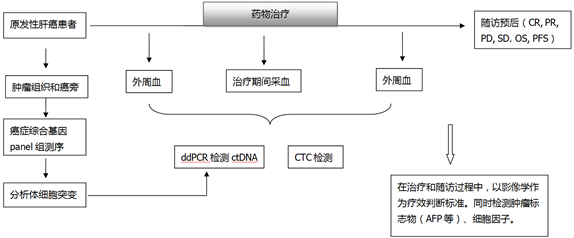
图8. ctDNA研究策略
(五)总结与展望
生物标志物的发现是一个不断发展的领域,分析和诊断的敏感性需得到进一步提高,以便分析ctDNA的特定突变基因。此外关于肿瘤的异质性方面即检测出的血浆ctDNA可反映全部的不同转移部位肿瘤的突变情况还是仅代表影响疾病进展和治疗抵抗的最重要的DNA突变则有待更深入地研究17。随着技术的进步和成本的降低,全基因组测序可能成为检验医学的常规工具。同时分析血浆DNA 的一系列过程则需进行标准化,并提高检测方法的敏感性18。
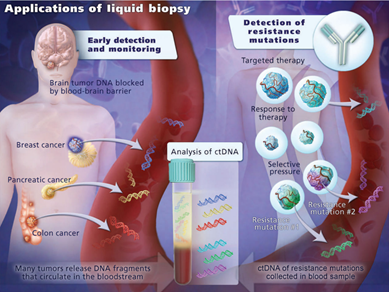
如今ctDNA技术尚未运用于临床实践,许多机制尚不十分清楚11。目前临床尚未开展多中心、大样本的基础以及临床研究,缺乏有价值的科研资料来指导临床,但随着广大科研工作人员对 ctDNA的不断探索和研究,ctDNA 将可能成为临床肿瘤学中一种具有重要意义的生物标志物。综上所述,ctDNA 技术作为一种方便、非侵入性、可重复性和高敏感性的“液态活检”技术,能够了解循环中肿瘤特异性突变,在肿瘤的早期诊断、疗效评估、复发和预后判断等方面发挥着重要的作用。以形态病理学为基础,以分子病理学为辅助。两者相辅相成,液态活检将为人类更深入地了解疾病的本质提供更丰富的、可靠的手段5。
在未来,ctDNA结合ddPCR技术或者新一代测序技术将有望实现:
1.早期筛查:在影像学未发现病灶时对被检测者进行早期筛查,判断肿瘤原发灶;
2.实时监控:ctDNA检测作为一种无创的检测方法,能够真实的反映实体瘤组织中的基因突变图谱与频率,并且能够进一步为患者提供最早的实时监控检测指标;
3.治疗反应:在治疗前后分别检测患者的ctDNA,可以及时检测患者体内的实体瘤相关基因的突变图谱及频率,监测患者的肿瘤负荷及对治疗的敏感性与耐药性;
4.判断预后:在治疗前或治疗后,对患者体内实体瘤相关基因进行监测,可以评估肿瘤特异性变异的突变频率,对医生判断患者的预后起到指导作用。
参考文献
1. Alix-Panabieres C, Schwarzenbach H, Pantel K. Circulating tumor cells and circulating tumor DNA. Annu Rev Med. 2012;63:199-215.
2. Weber C. Pancreatitis: Alternatively activated macrophages mediate fibrosis. Nat Rev Gastroenterol Hepatol. 2015 Jul;12(7):372.
3. Turajlic S, Swanton C. Gastrointestinal cancer: Tracking tumour evolution through liquid biopsy. Nat Rev Clin Oncol. 2015 Oct;12(10):565-6.
4.Murtaza M, Dawson S-J, Pogrebniak K, Rueda OM, Provenzano E, Grant J, et al. Multifocal clonal evolution characterized using circulating tumour DNA in a case of metastatic breast cancer. Nat Commun. 2015;6.
5.Del Re M, Tiseo M, Bordi P, D'Incecco A, Camerini A, Petrini I, et al. Contribution of KRAS mutations and c.2369C > T (p.T790M) EGFR to acquired resistance to EGFR-TKIs in EGFR mutant NSCLC: a study on circulating tumor DNA. Oncotarget. 2016 Jan 20.
6.Chu D, Paoletti C, Gersch C, VanDenBerg DA, Zabransky DJ, Cochran RL, et al. ESR1 Mutations in Circulating Plasma Tumor DNA from Metastatic Breast Cancer Patients. Clin Cancer Res. 2016 Feb 15;22(4):993-9.
7. Meador CB, Lovly CM. Liquid biopsies reveal the dynamic nature of resistance mechanisms in solid tumors. Nat Med. 2015 Jul;21(7):663-5.
8.Weiss L, Hufnagl C, Greil R. Circulating tumor DNA to monitor metastatic breast cancer. N Engl J Med. 2013 Jul 4;369(1):93.
9. Dawson SJ, Tsui DW, Murtaza M, Biggs H, Rueda OM, Chin SF, et al. Analysis of circulating tumor DNA to monitor metastatic breast cancer. N Engl J Med. 2013 Mar 28;368(13):1199-209.
10.Cristofanilli M, Fortina P. Circulating tumor DNA to monitor metastatic breast cancer. N Engl J Med. 2013 Jul 4;369(1):93.
11.Bettegowda C, Sausen M, Leary RJ, Kinde I, Wang Y, Agrawal N, et al. Detection of circulating tumor DNA in early- and late-stage human malignancies. Sci Transl Med. 2014 Feb 19;6(224):224ra24.
12.Newman AM, Bratman SV, To J, Wynne JF, Eclov NC, Modlin LA, et al. An ultrasensitive method for quantitating circulating tumor DNA with broad patient coverage. Nat Med. 2014 May;20(5):548-54.
13.Vogelstein B, Kinzler K, Landau M. An interview with Bert Vogelstein and Kenneth Kinzler. Clin Chem. 2015 Jan;61(1):9-20.
14.Masters GA, Krilov L, Bailey HH, Brose MS, Burstein H, Diller LR, et al. Clinical cancer advances 2015: Annual report on progress against cancer from the American Society of Clinical Oncology. J Clin Oncol. 2015 Mar 1;33(7):786-809.
15.Crowley E, Di Nicolantonio F, Loupakis F, Bardelli A. Liquid biopsy: monitoring cancer-genetics in the blood. Nat Rev Clin Oncol. 2013 Aug;10(8):472-84.
16.Huang W, Qi CB, Lv SW, Xie M, Feng YQ, Huang WH, et al. Determination of DNA and RNA Methylation in Circulating Tumor Cells by Mass Spectrometry. Anal Chem. 2016 Jan 19;88(2):1378-84.
17.Alix-Panabieres C, Pantel K. Clinical Applications of Circulating Tumor Cells and Circulating Tumor DNA as Liquid Biopsy. Cancer Discov. 2016 Mar 11.
18.Ray K. Colorectal cancer: Liquid biopsy enables real-time monitoring of molecular alterations in CRC. Nat Rev Gastroenterol Hepatol. 2015 Jul;12(7):372.
二、液态活检之循环肿瘤细胞(CTC)研究进展及技术平台简介
(一)CTC基础知识
1. CTC的基本概念
1869年,澳大利亚学者Ashworth在一例转移性肿瘤患者血液中首次观察到从实体肿瘤中脱离并进入血液循环的肿瘤细胞,并首次提出了循环肿瘤细胞(CTC)的概念1。1976年,Nowell将CTC的定义修正为:来源于原发肿瘤或转移肿瘤,获得脱离基底膜的能力并入侵通过组织基质进入血管的肿瘤细胞。上世纪90年代,科学家开始对CTC的临床意义进行研究。2000后,CTC日益成为临床上液态活检标志物的研究热点,并在临床越来越广泛的应用3,4。
2. CTC的特点3-5
2.1 可能是单个细胞从病灶脱落进入外周血,也可能是成簇脱落;
2.2 不同CTC在形态上有较大差别;
2.3 CTC有很强的异质性,不同类型的肿瘤CTC差别很大,即使同一病人来源的不同CTC细胞表所表达的标志物种类及表达量也有差异;
2.4 CTC可能在循环过程中发生上皮间质转化(EMT)逐渐丧失上皮标志物;
2.5血液中存在可检测CTC的患者比例随癌症类型的不同而不同。比如结直肠癌、卵巢癌和乳腺癌大约是50-70%,而非小细胞肺癌则低至30%;
2.6 CTC活力强,有抗脱巢凋亡活性;
2.7 CTC有侵袭和转移潜能。
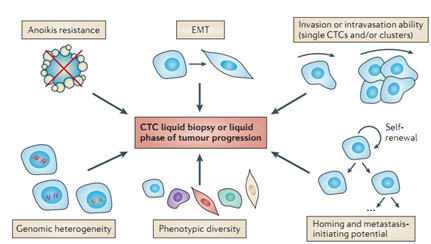
图1. CTC的特点
(二)CTC检测技术
血液中大部分成分是白细胞和红细胞,CTC所占的比例相对较少。每10mL血液中,含有1亿个白细胞和500亿个左右红细胞,而CTC的数目可能仅有几个到几十个。想要准确地检测CTC细胞数目依赖非常灵敏的检测手段。近年来随着现代医学研究技术的进步和CTC临床应用价值凸显,许多研究机构和研发团队都在推出不同的CTC检测技术。CTC检测技术包括CTC的富集(分离)和CTC的分析鉴定(识别)等5。
1、CTC富集(分离)
1.1 免疫亲和法
建立在免疫亲和原理上的CTC富集方法,利用特异性抗体与细胞表面抗原进行特异性结合来富集CTC。基于免疫亲和的方法也分为很多种5:
1.1.1免疫磁珠法:以CellSearch®法为代表,在磁珠上包被细胞表面粘附分子EpCAM,来捕获CTC。临床研究证明该方法检测出的CTC数目与肿瘤的预后密切相关。FDA已批准CellSearch®检测的CTC数目用于预测转移性乳腺癌,前列腺癌,结直肠癌的预后。
1.1.2微流体法:Nagrath和Toner的团队研发了一种用于捕获CTC的微流体。上面有78,000个微柱与EpCAM的抗体相结合,可直接捕获全血中的CTC。整个微流体共有970 mm2的表面积,在2mL/hour的通量下,CTC捕获效率>60%,特异性在50%左右。在多种转移肿瘤中该方法已被证明有较高的CTC捕获效率。
1.1.3纳米结构基体:Wang et al等人将EpCAM抗体结合在硅质的纳米基体上,进行CTC捕获。1mL/hour的通量下,可以达到95%以上的捕获效率。一项研究利用该方法对26例前列腺癌进行检测,CTC的检出率为20/26,明显高于CellSearch®系统(8/26)。
1.1.4微量离心管:由Hughes et al研制,在微量离心管上包被EpCAM及PSMA的抗体,4.8mL/hour的通量下,捕获率可达50%,特异性达66%。用该方法对14例转移性肿瘤患者进行CTC检测,检出率为100%,明显高于CellSearch®系统(9/14)。
1.1.5体内富集:将结合EpCAM的装置从前臂静脉插入病人体内,并停留30min,从而进行体内CTC富集。临床实验证明这种方法对乳腺癌和肺癌的CTC细胞均有较高的捕获效率。
1.1.6白细胞去除法:属于阴性富集法。用特异性抗体CD45,CD14等与白细胞结合,从而去除全血中的白细胞。该方法比其它富集方法捕获效率更高,但特异性明显低于其它方法。
利用抗原抗体相互作用原理的CTC富集方法可得到较高的纯度。但捕获效率对细胞表面抗原的表达情况依赖较明显。对于依赖EpCAM的捕获方法,CTC捕获效率与细胞表皮抗原的表达情况密切相关,一些CTC可能由于EMT过程中表皮抗原发生变化而未被捕获。另外EpCAM法仅限于对上皮来源的CTC进行检测。相对于其它方法,免疫亲和法对CTC的富集效率偏低。
1.2 物理特性富集法
依据CTC的物理特性,如密度、大小、可变形性及表面电荷等进行富集。